

監修:慶應義塾大学医学部内科学(神経)教室 教授 中原 仁 先生


補体とアストロサイト破壊の関係性を中心に、NMOSDの病態メカニズムを紹介致します。
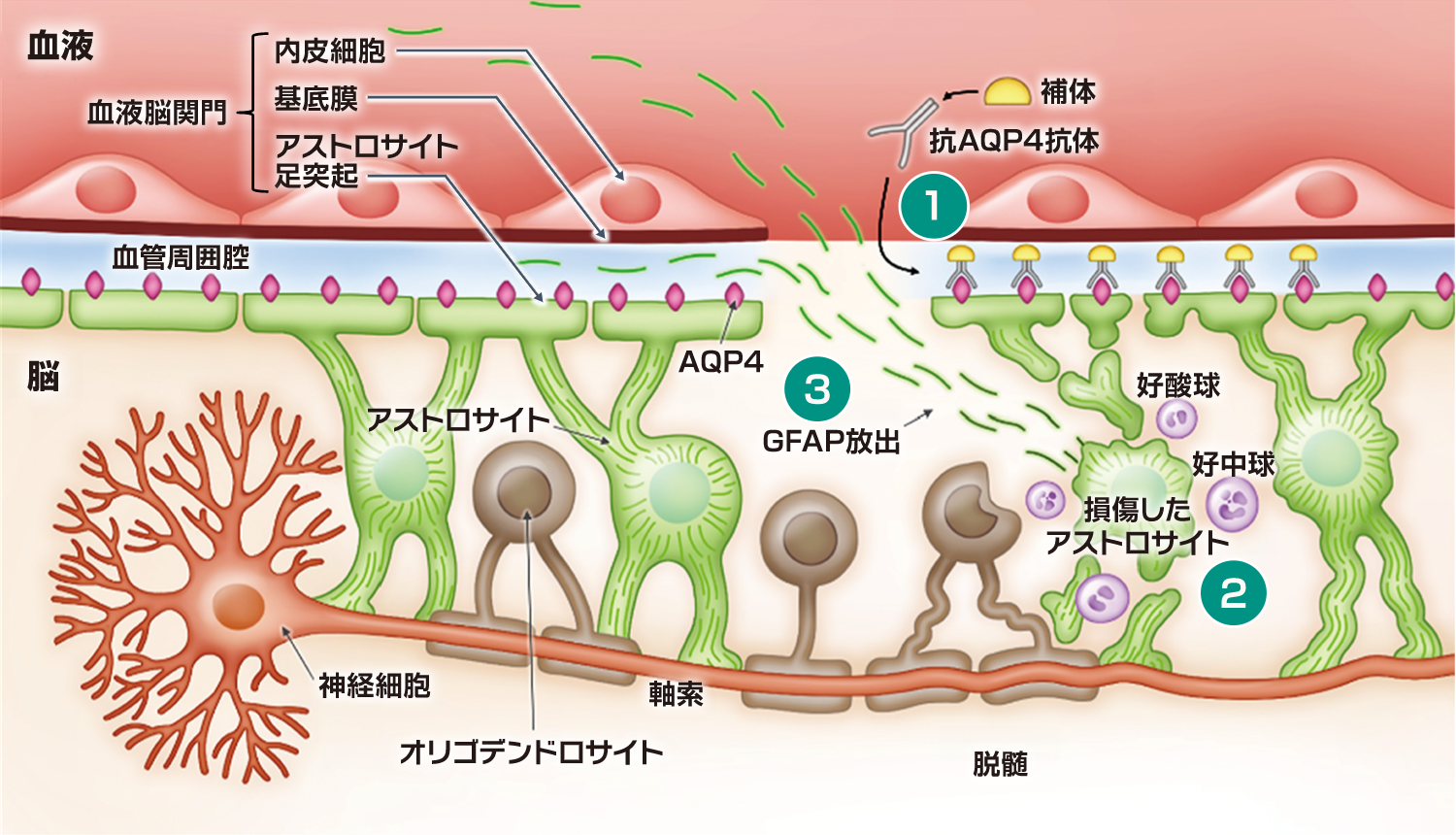
抗アクアポリン4(AQP4)抗体陽性の視神経脊髄炎スペクトラム障害(NMOSD)は、抗AQP4抗体が関与し、中枢神経のアストロサイトの傷害を引き起こす自己免疫疾患とされています。
また、抗AQP4抗体陽性NMOSDの発症機序には補体タンパク質が深く関わっています。本コンテンツでは、補体とアストロサイト破壊の関係性を中心に、NMOSDの病態メカニズムを紹介致します。

レセプターで抗原を感知すると、いっせいに集まり攻撃(貪食)します。また、好中球には補体を感知するレセプターが存在します。
NMOSDでは、補体C5aが好中球の走化因子として作用し、好中球を局所へ呼び寄せ、血液脳関門(BBB)の透過性を高め、炎症を誘導します。
抗AQP4抗体陽性NMOSDの発症機序には補体タンパク質が深く関わっています。




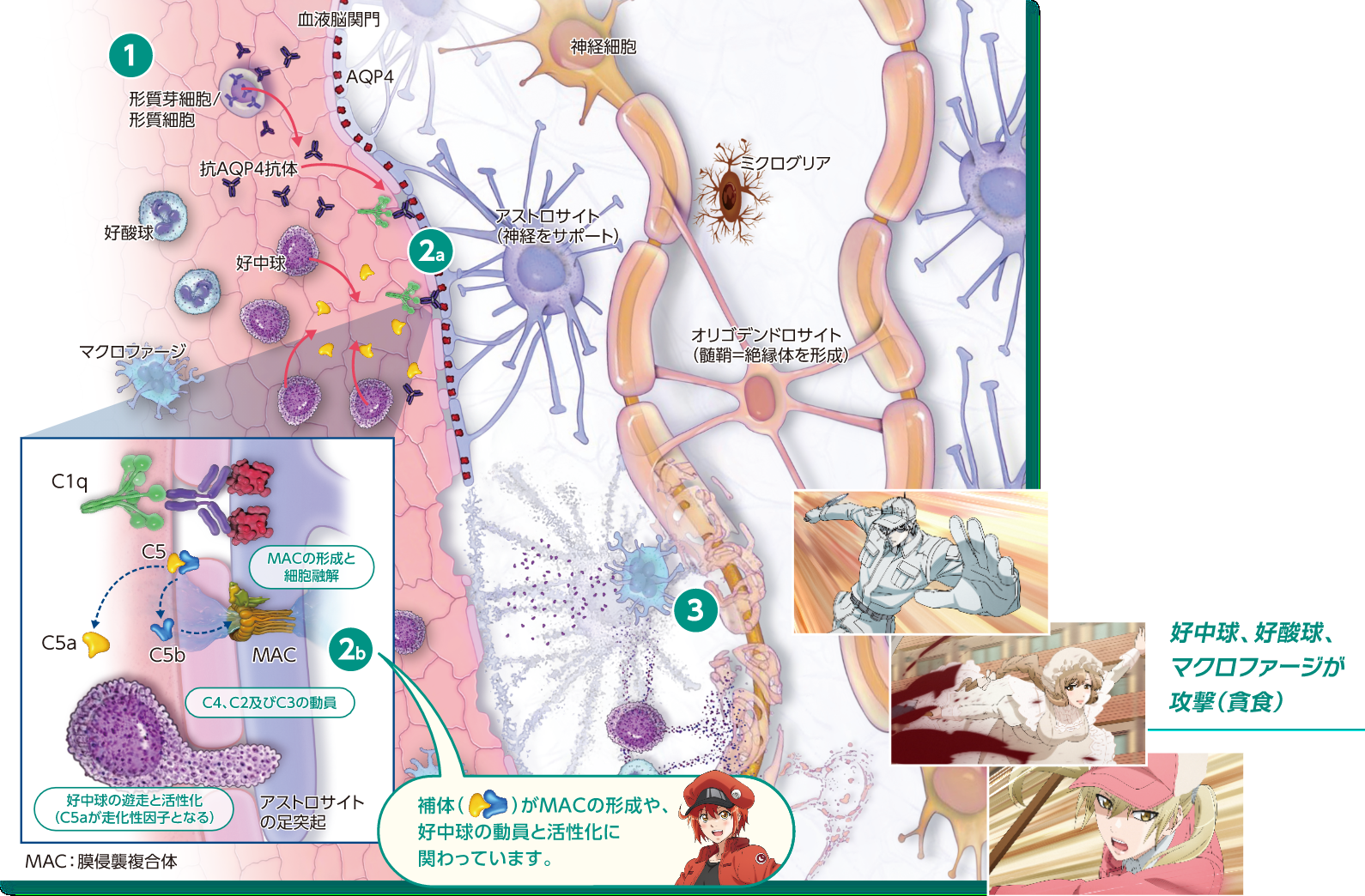

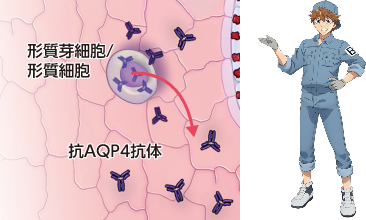
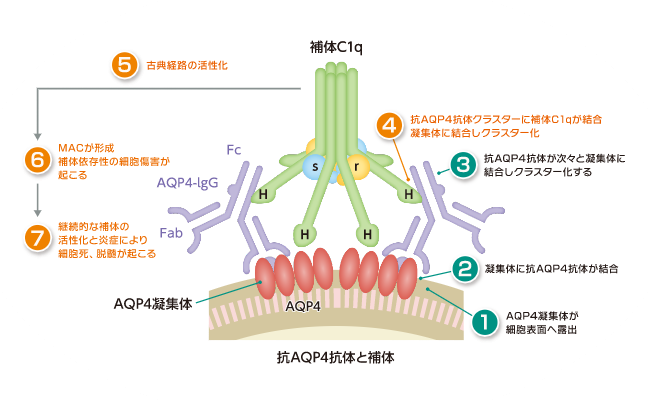
形質芽細胞および形質細胞から抗AQP4抗体が産生されます1)

形質芽細胞および形質細胞から産生された抗AQP4抗体がアストロサイトの足突起上のAQP4に結合し、補体系が活性化されます1)
補体C5がC5aとC5bに開裂し、補体C5aが多形核白血球(PMN)を活性化してBBB透過性を高め、炎症を誘導します2)
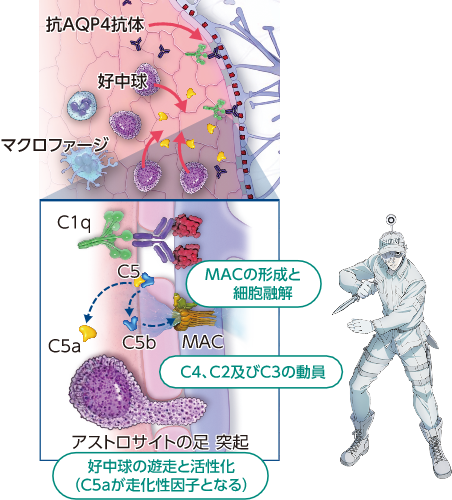

補体C5bは、MACの形成、アストロサイトの損傷を引き起こします3)
継続的な補体系の活性化と炎症により、アストロサイトの細胞死、脱髄、神経細胞死が引き起こされます3)

1)Weinshenker BG, et al. Mayo Clin Proc 2017; 92: 663-679.
2)Winkler A, et al. J Clin Invest 2021; 131: e141694.
3)Papadopoulos MC, et al. Nat Rev Neurol 2014; 10: 493-506. 監修:国際医療福祉大学 医学部 脳神経内科学 教授
竹内英之 先生
※「はたらく細胞」は科学教育エンターテインメント作品です。 科学的に完全に正しいものではなく、分かりやすさを優先した表現が含まれています。

抗AQP4抗体陽性NMOSDでは、抗AQP4抗体だけではアストロサイト破壊に対する病原性は発揮されず、補体がともにはたらくことでアストロサイトが破壊されることが確認されました。
抗AQP4抗体と補体によるアストロサイトの破壊への影響を検討した研究では、アストロサイトの破壊は抗AQP4抗体のみではなく、補体存在下で病原性を発揮することが報告されています。
さらに、GFP発現マウスを用いたin
vitroの研究により、抗AQP4抗体とヒト補体が共存した状態では、約3時間でアストロサイトの死滅および損傷が認められました。
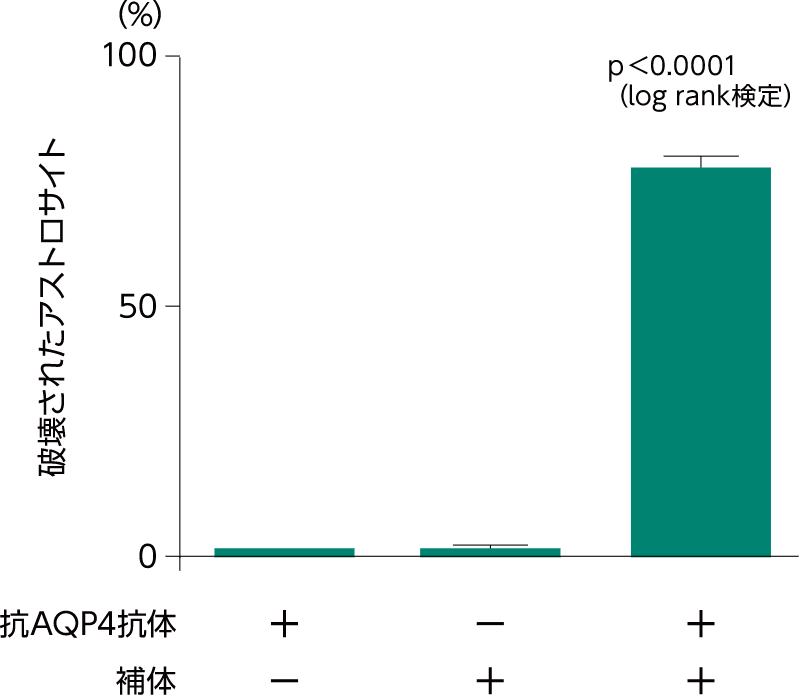
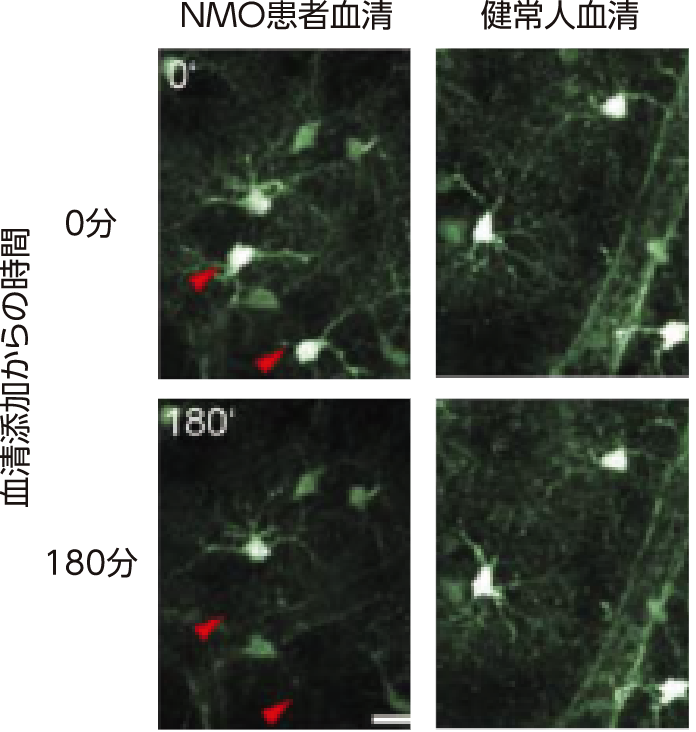
【研究概要】
(左)in
vitroイメージングによりアストロサイトの破壊を検出した。抗AQP4抗体を含むNMO患者血清を30分おきに3回塗布し、タイムラプスの画像を3分間おきに3時間取得した。(右)GFP発現マウスの脳スライスに、抗AQP4抗体を含むNMO患者血清および健常人血清を添加した。タイムラプスにより3時間観察し、アストロサイトの破壊を観察した。抗AQP4抗体除去はAQP-4吸着カラムを用い、また補体の不活性化は加熱処理により行った。
[本研究の限界:NMO モデルマウスは補体の固有活性が低く、またマウスには補体の古典的活性化経路を阻害する成分が存在するため、NMO サンプルとともにヒト補体を用いる必要がある。抗AQP4 抗体の供給源とヒト補体の供給源を分離することで、このような変動要因をコントロールできたが、本来のNMO 病変では内因性補体が用いられるため、今回のモデルで観察されたものとは異なる動態や異なる傷害スペクトルを示す可能性がある。抗AQP4 抗体の直接添加は、広い面積を露出させた漿膜表面に行われており、血液脳関門が破壊されることによる血清抗AQP4 抗体の一次侵入経路として広く想定されているものとは乖離がある。]
Herwerth M, et al. Ann Neurol 2016; 79(5): 794-805.

NMOSDの病期に着目した、補体とアストロサイト傷害の関係について紹介致します。
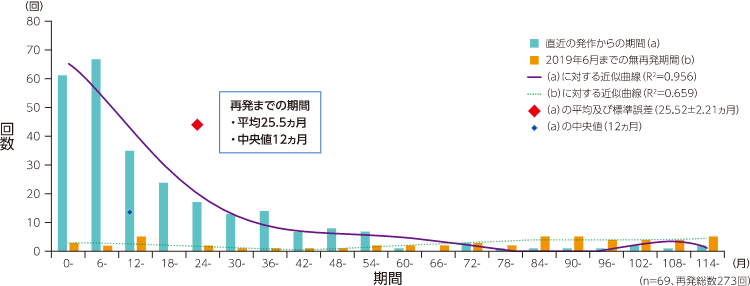
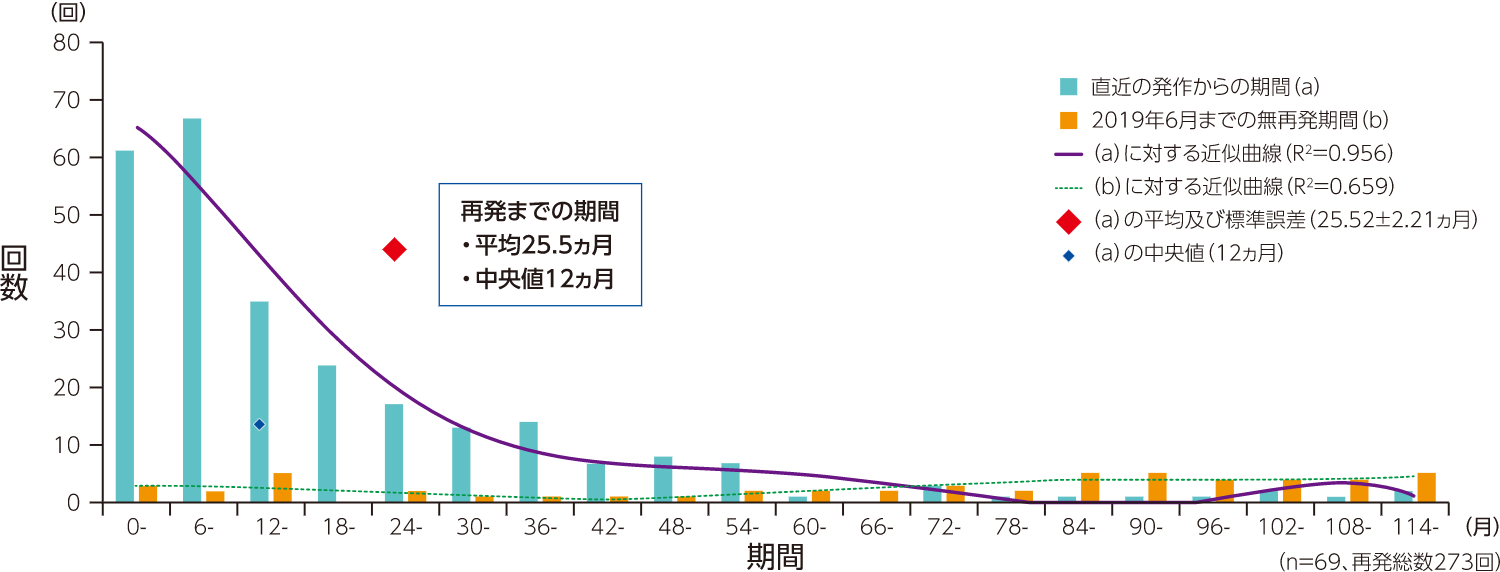
視神経脊髄炎スペクトラム障害(NMOSD)の再発は予測困難であり、一度発症してしまうと、発作後は再発が群発する傾向があると報告されており、「二度と再発を起こさせないようにすること」が重要です。また、アストロサイトの損傷は活動期だけではなく、寛解期にも生じていることが報告されています。本コンテンツでは、NMOSDの病期に着目した、補体とアストロサイト損傷の関連について紹介致します。
ヘルパーT細胞の指令により抗体を作ります。
NMOSDでは、B細胞から分化した形質芽細胞および形質細胞から自己抗体である抗AQP4抗体が産生され、補体がともにはたらくことでNMOSDの病態が進行することが知られています。


NMOSD患者さんでは、活動期だけでなく、寛解期においても脳脊髄液および血清中のC5aが上昇していることが報告されています。
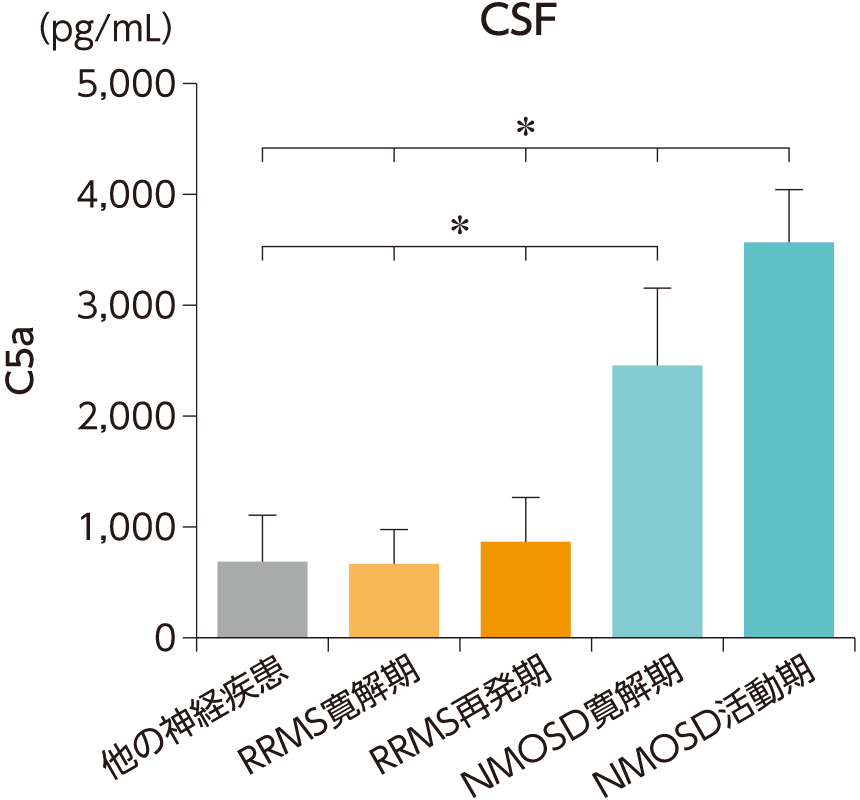
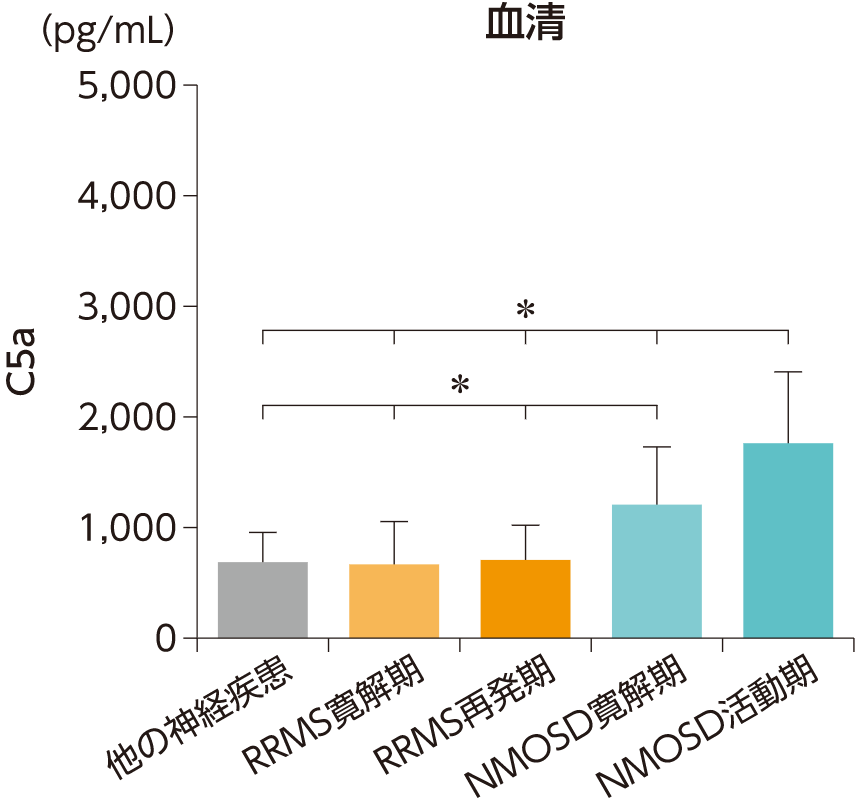
【研究概要】
NMOSD患者7例(寛解期3例、活動期4例)、RRMS患者8例(寛解期4例、再発期4例)、他の神経疾患患者8例を対象として、脳脊髄液中および血清中の補体C5a濃度を測定し、NMOSD(寛解期・活動期)とRRMSや他の神経疾患で比較した。
[本研究の限界:各群の例数が少ない。NMOSD群では男女比がほぼ等しく、NMOSDの代表的な疫学的分布ではない(しかし、好中球機能、補体成分濃度およびアストロサイト形態の性別による大きな相違に関するデータはない)。]
Piatek P, et al. Front Immunol 2018; 9: 1694.

アストロサイトの傷害・破壊は、活動期だけで生じているのではなく、症状が伴わないこともある寛解期でも生じていることが報告されています。
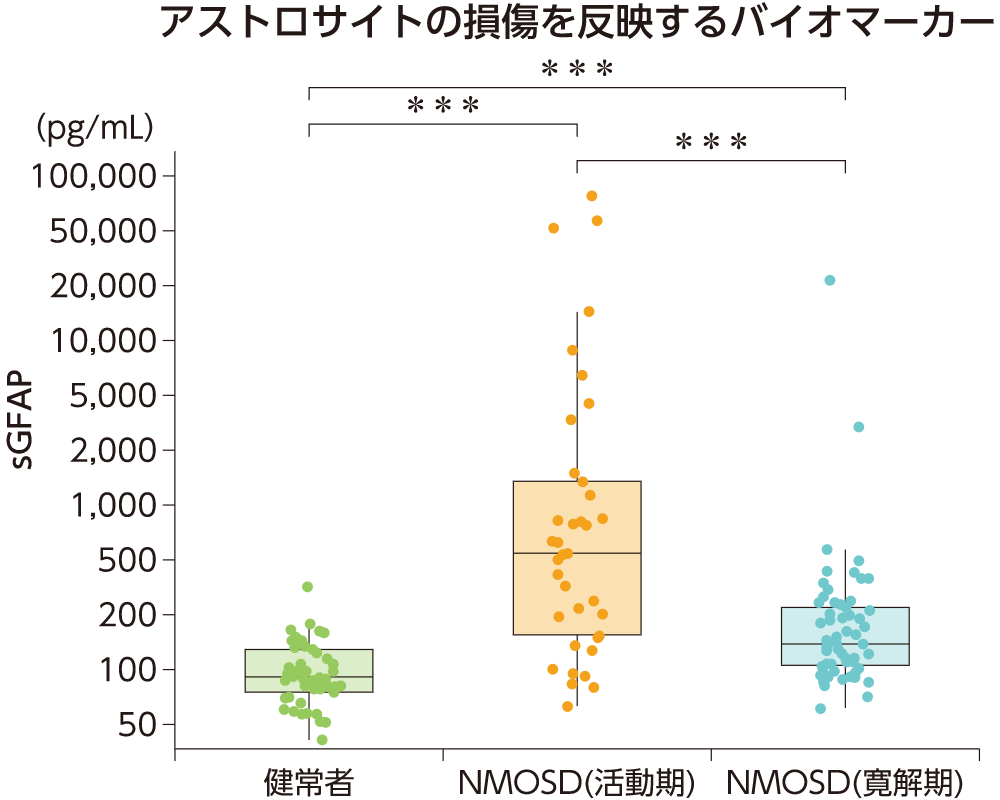
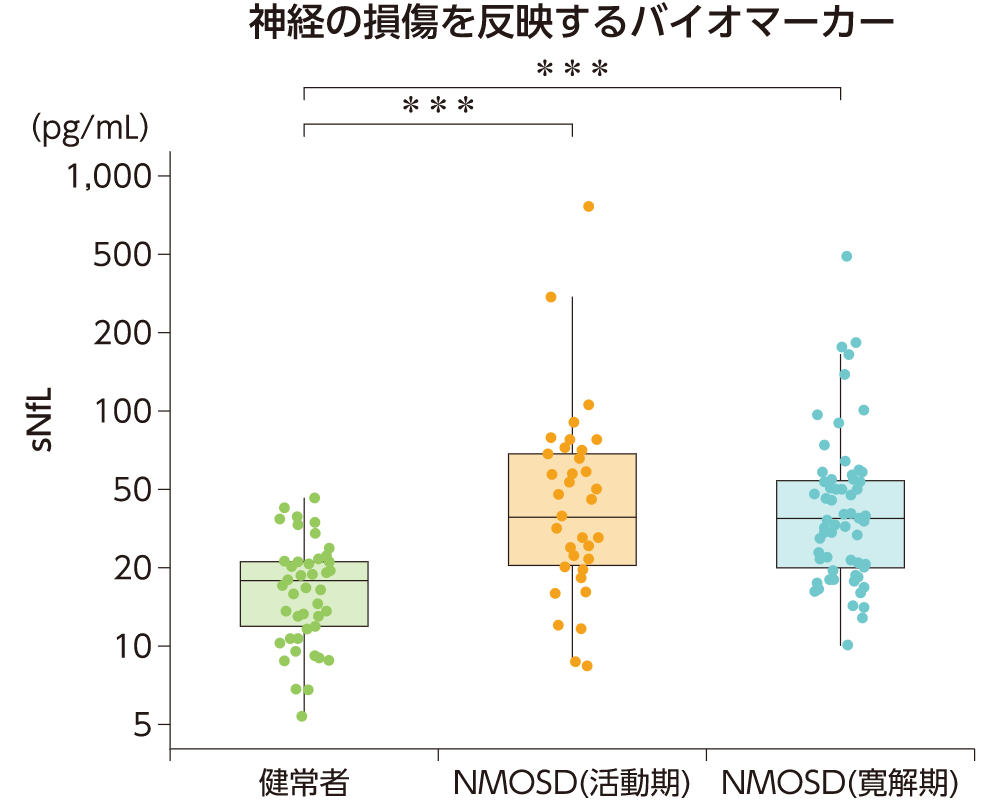
【研究概要】
九州大学病院において健康人49例の血清49標本、NMOSD患者33例の脳脊髄液42標本と血清102標本、MS患者49例の脳脊髄液53標本と血清91標本におけるGFAP濃度およびNfL濃度を、高感度Single
Molecule
Array(SimoaTM)※1-2を用いて測定した。それぞれのグループ間における血清GFAP濃度、血清NfL濃度および血清GFAP濃度/NfL濃度比の統計学的差を混合効果モデル(年齢と性別で調整)を用いて検定した。
[本研究の限界:本研究は後ろ向きの研究デザインで、フォローアップされた臨床的情報に限りがあった。]
Watanabe M, et al. Neurology 2019; 93: e1299-e1311. より改変


※「はたらく細胞」は科学教育エンターテインメント作品です。 科学的に完全に正しいものではなく、分かりやすさを優先した表現が含まれています。

補体のはたらきや補体活性化経路について紹介致します。
補体は、免疫システムの一部であり、感染から身体を守るために重要な役割を果たします。しかし、補体系のバランスが崩れる、または調節不全に陥ると、自己の細胞や組織を攻撃する制御不能な連鎖反応を引き起こし、自己免疫疾患を引き起こすこともあり得ます。本コンテンツでは、補体のはたらきや補体活性化経路について紹介致します。
異物の駆除や、抗原の情報をヘルパーT細胞に提示します。血管内では単球として存在していますが、組織へ移動するとマクロファージへと分化します。
補体C5aがマクロファージの走化因子として作用し、マクロファージを局所へ呼び寄せます。




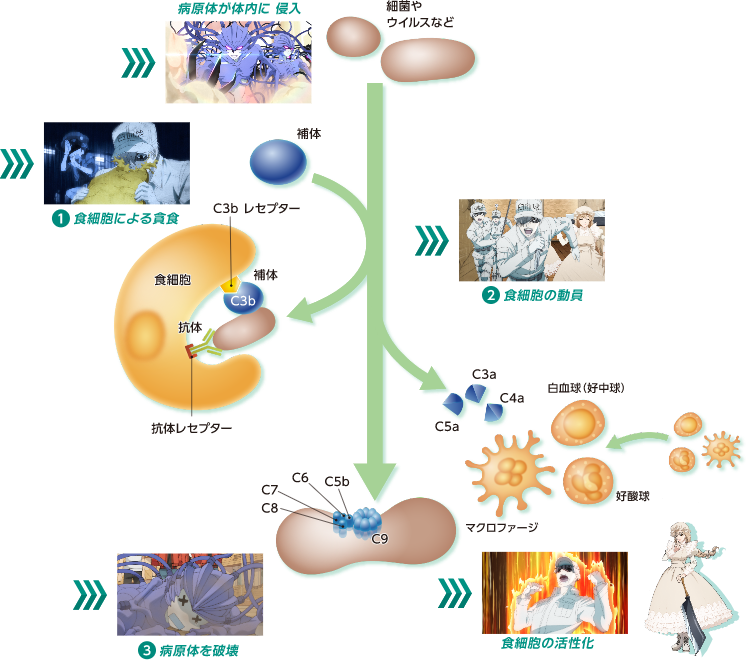

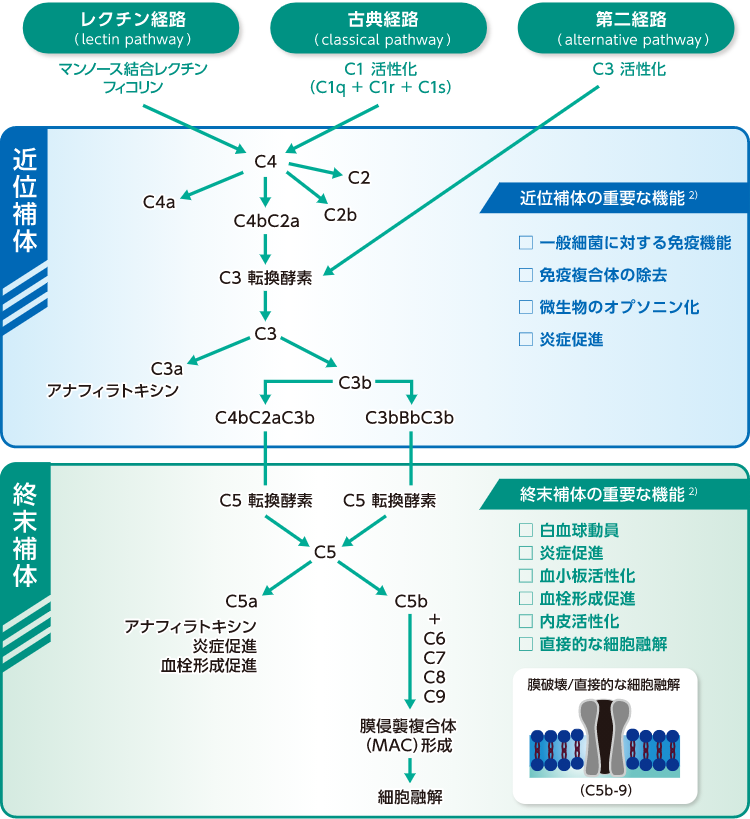
異物が体内に侵入すると、補体経路が活性化し、補体C3がC3aとC3bに分解します。C3bは異物に対して共有結合し、「非自己」と標識(オプソニン化)することで、食細胞(好中球、マクロファージなど)は、異物を効率的に貪食できるようになります。




食細胞による貪食
補体経路が活性化する過程で生成される補体の分解産物であるC3aやC5aは、アナフィラトキシンとも呼ばれ、それらに対する受容体を発現する細胞に作用し、炎症を増強します。 C3aよりも安定かつ強力に作用するC5aは、それに対する受容体を発現する食細胞(好中球、マクロファージなど)に対して走化性因子として作用し、食細胞を局所へ呼び寄せます。また、C5aの結合は食細胞表面のCR1やCR3の発現を増強させ、異物に対して効率的な貪食処理を促進します。




食細胞の動員
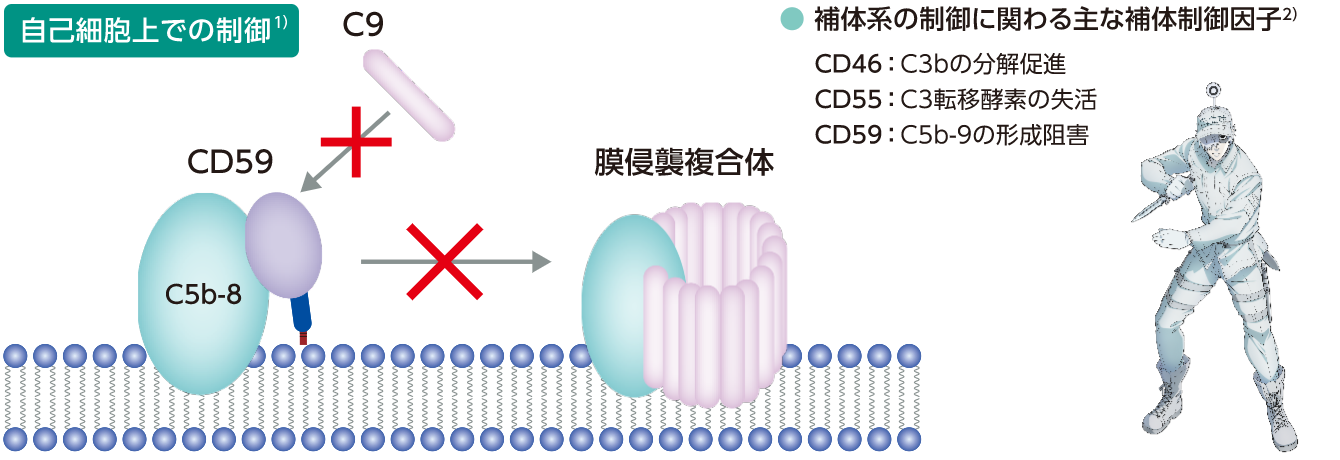
補体活性化の結果、最終的な産物として細胞膜上にMACが形成(C5bにC6、C7、C8と複数のC9が重合)され、細胞膜に穴をあけ破壊します。 MACは自己の細胞表面にも形成され得ますが、通常は細胞膜上の補体制御因子であるCD59がC9の重合を阻害することで、MACの形成が阻止され、補体活性化による細胞破壊から自己の細胞を守っています。



病原体を破壊
1)日本補体学会. FOCUS補体シリーズ第1回 2018, 2-5. 2)町田 豪, 関根 英治. 補体の多面性:自然免疫・獲得免疫と補体. 日本臨牀 2022, 80, 1728-1734.
※「はたらく細胞」は科学教育エンターテインメント作品です。 科学的に完全に正しいものではなく、分かりやすさを優先した表現が含まれています。
補体系には、多くの血清タンパク質と膜タンパク質から構成される因子が、決まった順序で次々と活性化される経路(カスケード反応)があります。主要な補体因子は1から9の番号を付したC1~C9(complement1~9)で表されます。また補体活性化の際に生じる分解産物は一般的には分子量が小さい方に「a」、大きい方に「b」が付され※、例えばC3の場合、C3aやC3bと表されます1)。 現在、補体の活性化経路は、古典経路(classical pathway)、第二経路(alternative pathway)、レクチン経路(lectin pathway)の3つが知られています。3つの活性化経路の反応開始機序は異なりますが、いずれの経路もC3以降へ進むと共通して、異物のオプソニン化に重要なC3bの産生と、MACの形成へとつながります。

補体系には、多くの血清タンパク質と膜タンパク質から構成される因子が、決まった順序で次々と活性化される経路(カスケード反応)があります。主要な補体因子は1から9の番号を付したC1~C9(complement1~9)で表されます。また補体活性化の際に生じる分解産物は一般的には分子量が小さい 方に「a」、大きい方に「b」が付され※、例えばC3の場合、C3aやC3bと表されます1)。
現在、補体の活性化経路は、古典経路(classical pathway)、第二経路(alternative pathway)、レクチン経路(lectin pathway)の3つが知られています。3つの活性化経路の反応開始機序は異なりますが、いずれの経路もC3以降へ進むと共通して、異物のオプソニン化に重要なC3bの産生と、MACの形成へとつながります。

※なお、C2については例外で、C2aが大きくC2bが小さい分解産物となります。

NMOSDの臨床的特徴と再発予防の重要性について紹介致します。
視神経脊髄炎スペクトラム障害(NMOSD)は再発を繰り返し、失明や歩行障害など重篤な後遺症を招く恐れがある中枢神経系の指定難病です。
NMOSDの再発は予測困難であり、再発の大小を問わず、一度発症してしまうと、発作後は再発が群発する傾向があると報告されています。このことから、たとえ小さな再発でも「二度と再発を起こさせないようにすること」が重要です。本コンテンツでは、NMOSDの臨床的特徴と再発予防の重要性について紹介致します。
細胞たちから届けられる抗原の情報をもとに、キラーT細胞には攻撃の指示を、B細胞には抗体を作る指示を出します。
NMOSDでは、自己抗体である抗AQP4抗体がB細胞により産生されます。









 再発の大小に関係なく、一度の発作がクラスター化のきっかけとなる可能性があります。
再発の大小に関係なく、一度の発作がクラスター化のきっかけとなる可能性があります。








 再発患者における神経障害の変化
再発患者における神経障害の変化



 無再発患者における神経障害の変化
無再発患者における神経障害の変化



補体が関与する自己免疫疾患と、NMOSDにおいて免疫複合体を除去する役割を担う“はたらく補体”について紹介致します。
補体は、感染防御において不可欠で、免疫において中心的な役割を担っています。
補体には、主に以下の2つのはたらきがあります。
生体において補体が過剰または不適切に活性化されると自己組織に対する攻撃が起こり得るため、補体を制御するシステムとして補体制御因子が存在します。補体系では補体の活性化と制御のバランスが保たれています。しかし、このバランスが崩れると自己免疫疾患を引き起こす場合があります。本コンテンツでは、補体が関与する自己免疫疾患と、NMOSDにおいて免疫複合体を除去する役割を担う“はたらく補体”について紹介致します。
体内に侵入した外来異物(寄生虫など)に対する防御を行います。
好中球よりも弱いですが、貪食も行います。
NMOSDでは補体C5aが走化因子として作用し、好酸球を局所へ呼び寄せます。





補体系は病原体や免疫複合体などの除去を行うシステムとして補体三大作用(1.異物の標識(オプソニン化)、2.食細胞の動員、3.殺菌作用)があり、異物などの侵入から身体を守るため重要な役割を担っています。
補体は、異物を適切に除去するために、活性化と制御の絶妙なバランスによって成り立っています。補体が関与する疾患は、活性化と制御のバランスが崩れることで起こります1)。
補体制御の異常で起こる疾患として、PNHやaHUSなどがあります。また、補体の過剰な活性化で起こる疾患としては自己免疫性神経疾患(NMOSDやMGなど)があげられます。
PNH : 発作性夜間ヘモグロビン尿症 / aHUS : 非典型溶血性尿毒症症候群











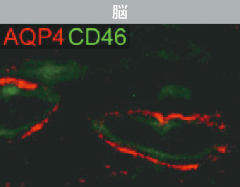 (左)AQP4(赤)/CD46(緑)
(左)AQP4(赤)/CD46(緑)
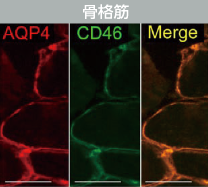 (右)AQP4(赤)/CD46(緑)
(右)AQP4(赤)/CD46(緑)


NMOSDのエキスパートである中原 仁 先生と『はたらく細胞』 のキャラクターが共演するNMOSDの病態、発症機序などを分かりやすく解説いただいたスペシャル・コラボ 動画です。

ここは人間の身体の中。ある日、NMOSDを発症した体内で戸惑う細胞たち。本動画では、NMOSDにおけるアストロサイト傷害と補体の関係について、慶應義塾大学医学部内科学(神経)教室の中原 仁先生が解説します。
NMOSDの初発から1年後。症状が落ち着き一安心している細胞たちに、中原先生が警鐘を鳴らします。本動画では、NMOSDの再発スタンバイ状態とその理由について解説します。
解説パンフレットをご入用の方は弊社担当MRまでお問い合わせください
補体とアストロサイト破壊の関係性を中心に、NMOSDの病態メカニズムを紹介致します。

NMOSDの病期に着目した、補体とアストロサイト傷害の関係について紹介致します。

補体のはたらきや補体活性化経路について紹介致します。

NMOSDの臨床的特徴と再発予防の重要性について紹介致します。
補体が関与する自己免疫疾患と、NMOSDにおいて免疫複合体を除去する役割を担う“はたらく補体”について紹介致します。

当ウェブサイトは、日本国内の医療関係者の方(医師、歯科医師、薬剤師、看護師等)を対象に、医療用医薬品の適正使用のための情報を提供しています。
一般の方や日本国外の医療関係者の方への情報提供を目的としたものではない事を
ご了承ください。