- C5Neurology
- NMOSD
- 製品情報
- ソリリス® 製品基本情報
- PREVENT継続試験
第Ⅲ相国際共同臨床試験(長期投与試験)
[ECU-NMO-302試験(PREVENT継続試験)]
(多施設共同非盲検非対照試験:ECU-NMO-301試験の継続試験)
視神経脊髄炎スペクトラム障害(NMOSD)患者を対象とした臨床試験は、すべて髄膜炎菌ワクチン接種下で実施されました。
社内資料:第Ⅲ相ECU-NMO-301継続試験(ECU-NMO-302)(承認時評価資料)
試験概要
| 目的 | NMOSD患者に対するソリリス®の長期的な安全性と有効性を評価する。 |
|---|---|
| 対象 |
再発のためECU-NMO-301試験を終了したNMOSD患者39例(うち日本人5例):
|
| 方法 | ECU-NMO-301試験の盲検性を維持するため、全患者が盲検下で投与される移行期を経た上で非盲検維持期に移行した。4週間の盲検下の移行期においては、ECU-NMO-301試験におけるソリリス®群にはソリリス® 1200 mg(1回目、3回目)又はプラセボ(2回目、4回目)を週1回投与し、ECU-NMO-301試験におけるプラセボ群にはソリリス® 900 mgを週1回、4週間投与した。初回投与4週後からの維持期には1回1200 mgを2週に1回投与した。投与期間は、ソリリス®がNMOSD患者に対する治療薬として(各国の規制要件に従って)承認され、市販されるまで、又は最初の患者が登録された時点から最長5.5年後のいずれか早い時期までである。 |
| 評価項目 |
主要評価項目:試験担当医師判定による試験中再発*に基づく年間再発率 試験中再発:試験中に発現する急性再発発作[24時間超持続する神経学的検査上の客観的変化(臨床徴候)を伴う神経学的症状の新たな発現又は悪化]と定義。徴候及び症状はNMOに起因するもので、関連する臨床的所見を伴わずMRI又はその他の画像検査所見にのみ異常が認められる場合は試験中再発とはみなさない。試験中再発の前30日以上にわたり臨床的に安定していなければならない。 副次評価項目:EDSS、mRS、HAI、EQ-5D-3L及びKFSスコアのベースラインからの変化量 |
| 解析計画 |
2018年5月31日をデータカットオフ日とし、中間解析を実施した。安全性及び有効性の解析対象集団は、ECU-NMO-302試験でソリリス®を1回以上投与された全患者(継続試験FAS)である。 RAC:盲検下の再発に関する独立評価委員会(Relapse Adjudication Committee) |
有効性
(1)年間再発率(試験担当医師判定)(主要評価項目)
試験担当医師判定による年間再発率の、過去(ECU-NMO-301試験の24ヵ月前)の年間再発率に対する変化量は、中央値で−1.923であり、有意な低下が認められました(p<0.0001 名目上のp値、Wilcoxon符号順位検定)。
年間再発率(試験担当医師判定、継続試験FAS)
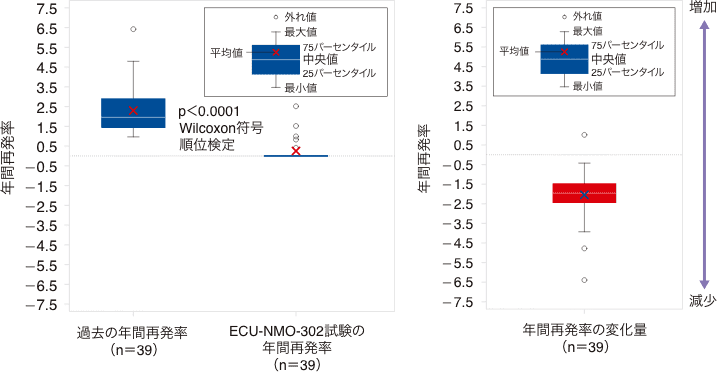
(2)年間再発率(RAC判定)(主要評価項目の感度分析)
RAC判定による年間再発率の、過去(ECU-NMO-301試験の24ヵ月前)の年間再発率に対する変化量は、中央値で−1.923であり、有意な低下が認められました(p<0.0001 名目上のp値、Wilcoxon符号順位検定)。
(3)EDSSスコアのベースラインからの変化量(副次評価項目)
ECU-NMO-302試験のベースラインからのEDSSスコアの変化量の中央値(最小、最大)は、26週時0(−2.5、1.0)及び52週時0(−2.5、1.5)であった。
EDSSスコアのECU-NMO-301試験ベースラインからの変化(継続試験FAS)
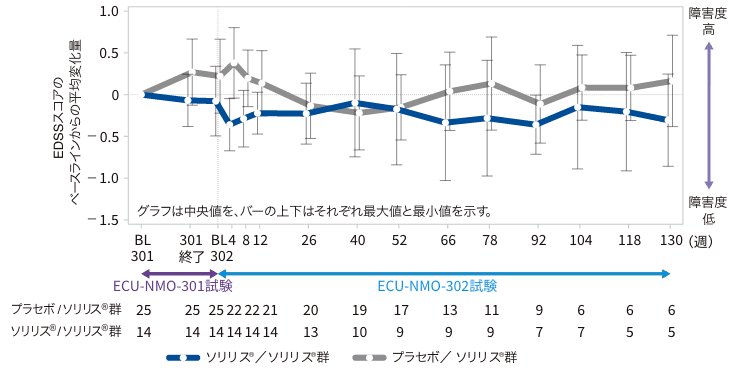
:プラセボ/ソリリス®群:ECU-NMO-301試験でプラセボ投与群に割付けられ、ECU-NMO-301 試験の継続試験であるECU-NMO-302試験でソリリス®が投与された群
:ソリリス®/ソリリス®群:ECU-NMO-301試験でソリリス®投与群に割付けられ、ECU-NMO-301 試験の継続試験であるECU-NMO-302試験でソリリス®が投与された群
(4)mRSスコアのベースラインからの変化量(副次評価項目)
ECU-NMO-302試験ベースラインからのmRSスコアの変化量の中央値(最小、最大)は、全体集団で26週時0(−2、2)及び52週時0(−2、2)でした。
mRSスコアのECU-NMO-301試験ベースラインからの変化(継続試験FAS)
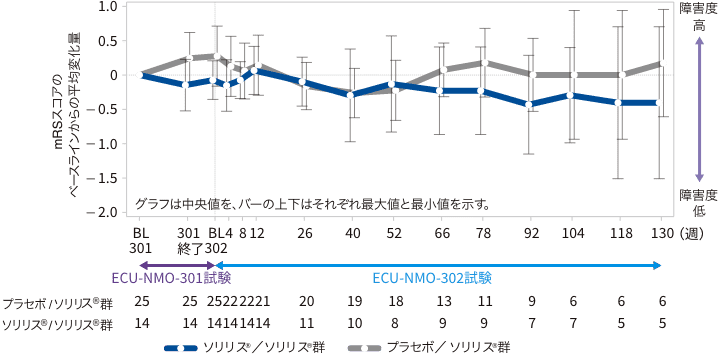
:プラセボ/ソリリス®群:ECU-NMO-301試験でプラセボ投与群に割付けられ、ECU-NMO-301 試験の継続試験であるECU-NMO-302試験でソリリス®が投与された群
:ソリリス®/ソリリス®群:ECU-NMO-301試験でソリリス®投与群に割付けられ、ECU-NMO-301 試験の継続試験であるECU-NMO-302試験でソリリス®が投与された群
(5)HAIスコアのベースラインからの変化量(副次評価項目)
ECU-NMO-302試験ベースラインからのHAIスコアの変化量の中央値(最小、最大)は、全体集団で26週時0(−4、1)及び52週時*0(−4、3)でした。
ソリリス®/ソリリス®群の52週時欠測
HAIスコアのECU-NMO-301試験ベースラインからの変化(継続試験FAS)
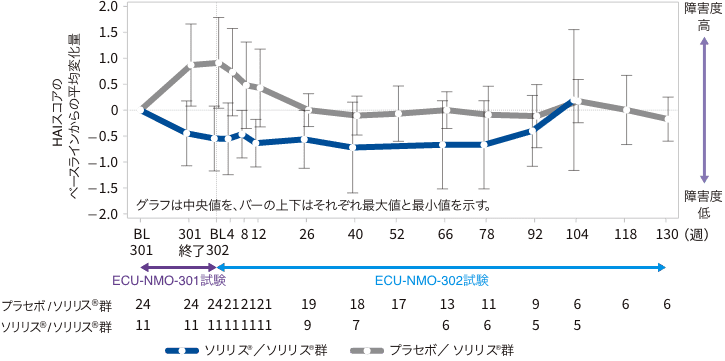
:プラセボ/ソリリス®群:ECU-NMO-301 試験でプラセボ投与群に割付けられ、ECU-NMO-301試験の継続試験であるECU-NMO-302試験でソリリス®が投与された群
:ソリリス®/ソリリス®群:ECU-NMO-301 試験でソリリス®投与群に割付けられ、ECU-NMO-301試験の継続試験であるECU-NMO-302試験でソリリス®が投与された群
(6)EQ-5D-3Lスコアのベースラインからの変化量(副次評価項目)
ECU-NMO-302試験ベースラインからのEQ-5D-3L VASスコアの変化量の中央値(最小、最大)は、26週時プラセボ/ソリリス®群では5.0(−30、35)、ソリリス®/ソリリス®群では0(−15、10)、52週時はそれぞれ0(−30、40)及び−3.0(−80、20)でした。
また、ECU-NMO-302試験のベースラインからのEQ-5D-3L Indexスコアの変化量の中央値(最小、最大)は、26週時プラセボ/ソリリス®群では0.02(−0.4、0.3)、ソリリス®/ソリリス®群では0(−0.02、0.2)、52週時はそれぞれ0(−0.4、0.3)及び0(−0.3、0.2)でした。
:プラセボ/ソリリス®群:ECU-NMO-301 試験でプラセボ投与群に割付けられ、ECU-NMO-301試験の継続試験であるECU-NMO-302試験でソリリス®が投与された群
:ソリリス®/ソリリス®群:ECU-NMO-301 試験でソリリス®投与群に割付けられ、ECU-NMO-301試験の継続試験であるECU-NMO-302試験でソリリス®が投与された群
安全性
ECU-NMO-302試験に移行した39例中27例(69.2%)に副作用が認められ、主な副作用は鼻咽頭炎、尿路感染症の各12.8%(各5例)でした。このうち日本人症例では、5例中5例(100%)にソリリス®との因果関係が否定できないと判断された副作用が認められ、2例以上に発現したものは白血球減少症2例(40%)でした。
重篤な有害事象は13例(33.3%)に認められ、視神経脊髄炎スペクトラム障害3例(7.7%)、尿路感染及び視神経炎が各2例(各5.1%)等でした。
投与中止に至った有害事象は、プラセボ/ソリリス®群で1例(シェーグレン症候群、自己免疫性甲状腺炎及びSLE悪化)に認められ、死亡及び注目すべき有害事象(AESI)として定義された髄膜炎菌感染症を発現した例はありませんでした。
注)治験薬との因果関係「おそらく関連なし(unlikely)」を含む
